Temel Konular
Ruhsatlandırma
Ülkemizde ilaçların ruhsatlandırma işlemleri, 1262 sayılı İspençiyari ve Tıbbi Müstahzarlar Kanunu ve Avrupa Birliği mevzuatına uyum çalışmaları çerçevesinde hazırlanan ve 19.01.2005 tarihinde yürürlüğe giren Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliği hükümlerine göre yapılmaktadır.
Başvuru dosyaları mevzuat gereğince, CTD formatında hazırlanır ve sunulur. CTD, Avrupa, ABD ve Japonya’daki ilaç ruhsatlandırma makamlarına yapılacak başvuruların planlı bir şekilde sunulmasını hedefleyen ve uluslararası alanda üzerinde uzlaşmaya varılan bir formattır.
CTD beş modülden oluşmaktadır;
- Modül 1: İdari Bilgiler
- Modül 2: Kalite Bilgileri, Klinik Dışı ve Klinik Özetler
- Modül 3: Kimyasal, Farmasötik ve Biyolojik Bilgiler
- Modül 4: Klinik Dışı Raporlar
- Modül 5: Klinik Çalışma Raporları
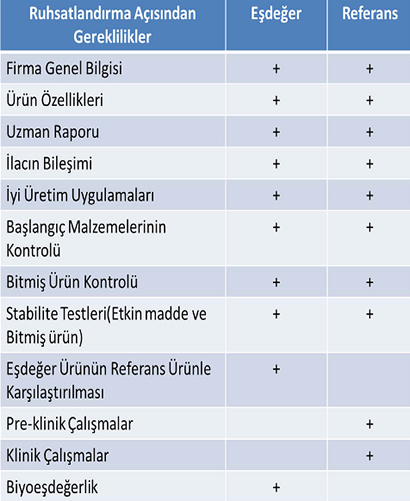
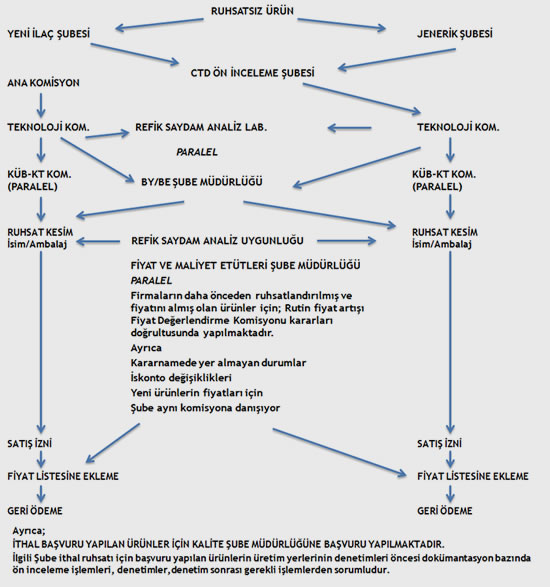
Ruhsatlandırma tarafında yaşanan sorunlardan biri 210 günlük ürün ruhsatlandırma süresine uyulmaması, pratikte bunun çok daha uzun zaman almasıdır.
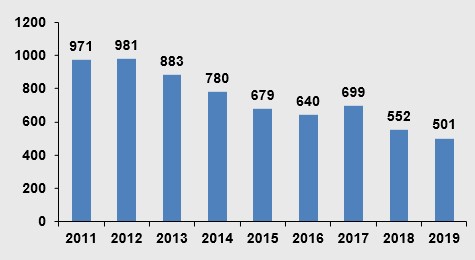
Yıllar İtibariyle Alınan Ruhsat Sayısı
2019 yılında toplam 501 ruhsat alınmıştır.